la struttura dell'atomo
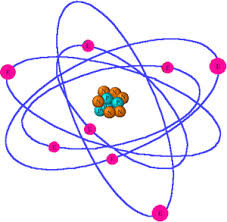
Il modello “planetario”
Nel 1911 il fisico Rutherford fece un esperimento cruciale: bombardò un sottilissimo
foglio di oro, posto fra una sorgente di particelle alfa e uno schermo. Le particelle, attraversando la lamina, lasciarono una traccia del loro passaggio sullo schermo.
L'esperimento portò alla constatazione che i raggi alfa non venivano quasi mai deviati; solo l'1% dei raggi incidenti era deviato considerevolmente dal foglio di oro (di questi solo alcuni
venivano completamente respinti).
Attraverso questo esperimento, Rutherford propose un modello di atomo in cui quasi tutta la massa dell'atomo è concentrata in una porzione molto piccola, il nucleo (caricato
positivamente) mentre gli elettroni gli ruotano attorno così come i pianeti ruotano attorno al Sole (modello
planetario)
L'atomo era dunque largamente composto da spazio vuoto, e questo spiegava il perché del passaggio senza deviazioni della maggior parte delle particelle alfa attraverso la lamina.
Il nucleo è così concentrato che gli elettroni gli ruotano attorno a distanze relativamente enormi, aventi un diametro da 10.000 a 100.000 volte maggiore di quello del nucleo. Rutherford intuì che i protoni da soli non bastavano a giustificare tutta la massa del nucleo e formulò l'ipotesi dell'esistenza di altre particelle, i neutroni, che contribuissero a formare l'intera massa del nucleo. Queste particelle furono successivamente scoperte da Chadwick nel 1932.

Ripetiamo: l'atomo è quindi composto principalmente da tre tipologie di particelle subatomiche (cioè di dimensioni minori dell'atomo): i protoni, i neutroni e gli elettroni.
In particolare:
· i protoni (carichi positivamente) e i neutroni (privi di carica) formano il "nucleo" (carico positivamente); protoni e neutroni sono detti quindi "nucleoni";
· gli elettroni (carichi negativamente) sono presenti nello stesso numero dei protoni e ruotano attorno al nucleo senza seguire un'orbita precisa , rimanendo confinati all'interno degli orbitali (o "livelli energetici").
NB: Le rappresentazioni grafiche dell'atomo sono spesso molto fuorvianti in relazione alle dimensioni delle sue parti, ma ciò serve a far vedere come sono disposte le diverse particelle.
Bisogna però ricordare che nella realtà il nucleo dell'atomo è straordinariamnete piccolo rispetto all'atomo stesso. In proporzione, se il nucleo atomico fosse grande quanto una palla da tennis, gli elettroni gli ruoterebbero attorno fino ad una distanza di qualche centinaio di metri;
Inoltre si ricordi che tutta la massa dell'atomo è quasi completamente concentrata nel nucleo, visto che gli elettroni sono molto leggeri rispetto a protoni e elettroni. Un nucleone (cioè un protone o un neutrone) ha massa quasi 1800 volte superiore a quella di un elettrone.
la massa atomica
Esiste una grandezza che ne quantifica la massa, definita peso atomico (più correttamente "massa atomica"), espresso nel SI in unità di massa atomica (ouma), dove una unità di massa atomica equivale alla dodicesima parte della massa di un atomo di carbonio-12 (12C).
Si definiscono due quantità per identificare ogni atomo:
· Numero di massa (A): la somma del numero di neutroni e protoni nel nucleo
· Numero atomico (Z): il numero dei protoni nel nucleo, che, allo stato neutro, corrisponde al numero di elettroni esterni ad esso.
Per ricavare il numero dei neutroni si sottrae al numero di massa il numero atomico.

il protone
Il protone insieme al neutrone è uno dei costituenti del nucleo dell’atomo Il protone ha massa è infatti circa 2000 volte maggiore di quella dell'elettrone e vale mp = 1.67 × 10-24 gr. Quindi per ottenere un grammo di materia servirebbero circa 0,6 × 10+24 protoni
Se immaginiamo il protone con la forma di una sfera avrebbe il raggio di circa 10-15 m Viene introdotta una nuova unità di misura di lunghezze detta FERMI che corrisponde circa al diametro di un protone
rp = 10-15 m = 1fm
l'elettrone
La carica elettrica del protone è positiva ma uguale, in modulo, uguale a quella dell'elettrone ma ha segno opposto, ovvero è positiva e vale 1.67 × 10-19 Coulomb
QP = - Qe- = Qe+
Delle tre particelle che costituiscono gli atomi, l'elettrone è di gran lunga il più leggero ed il più piccolo.
La sua massa vale: me = 9.1 × 10-28 gr
Il raggio dell'elettrone è piccolissimo comunque difficilmente definibile (è allo stesso tempo onda e corpuscolo). Il simbolo per indicare l’elettrone è " e- " e la sua carica elettrica è negativa ed identica in modulo a quello del protone e vale -1.67 × 10-19 Coulomb detta anche carica elementare e fa da riferimento alla determinazione delle altre cariche atomiche.
La scoperta degli elettroni risale al 1897 ed è dovuta a J. J. Thompson.
il neutrone

Il neutrone insieme al protone costituisce il nucleo dell’atomo e viene si indica con il simbolo " n ". La massa del neutrone vale 1,67 × 10−27kg.
Il raggio del neutrone è rn = 1 fm, come quello del protone.
Esso non ha carica elettrica, ovvero è una particella elettricamente neutra
La tabella seguente riassume alcune caratteristiche delle tre particelle subatomiche anzidette:
|
Particella |
Simbolo |
Carica |
Massa |
|
Elettrone |
e- |
-1,6 × 10−19 C |
9,109 × 10−31 kg |
|
Protone |
p+ |
1,6 × 10−19C |
1,671 × 10−27 kg |
|
Neutrone |
n |
0 C |
1,67 × 10−27 kg |
